Eetstoornissen op pediatrie
Dit stappenplan brengt verschillende basiselementen samen bij de aanpak van eetstoornissen op de dienst pediatrie van algemene ziekenhuizen.

Dit stappenplan brengt verschillende basiselementen samen bij de aanpak van eetstoornissen op de dienst pediatrie van algemene ziekenhuizen.
Op basis van het individueel groeitraject en de BMI-groeicurve werd een individueel minimaal gezond gewicht (MGG) en optimaal gewicht (OG) bepaald (zie hoofdstuk 5 en Bijlage 6. Minimaal gezond gewicht en optimaal gewicht). Afspraken omtrent de wekelijkse gewichtstoename om het afgesproken minimaal gezond gewicht te bereiken worden gemaakt. Doorgaans raden aanbevelingen een gewichtstoename van 0,5 – 1 kg per week aan bij jonge tieners met een eetstoornis, in opname [15, 44, 45, 92]. Deze aanbeveling ligt dus hoger dan de vooropgestelde gewichtstoename van 0,5 kg per week in de ambulante setting (200-500g/week of 0,3-0,5 kg/week bij chronische en zeer ernstige anorexia nervosa bij oudere individuen) [46, 94]. Toch dient ook vanuit klinische ervaring benoemd te worden dat dit voornamelijk afhangt van de ernst van het ondergewicht. Bij jonge patiënten (<12jaar) of bij ernstige ondervoeding kan het doel op een lagere gewichtstoename gelegd worden, bv. 300g / week (expertgroep).
In de literatuur bestaat er voorzichtige besluitvorming omtrent het gegeven dat er méér gewichtstoename merkbaar is, en daaraan gelinkt minder noodzaak tot gebruik van sondevoeding (nasogastric feeding), wanneer er eetondersteuning of positieve supervisie is tijdens de eetmomenten bij patiënten met anorexia nervosa [93]. Hoewel deze besluitvorming hoofdzakelijk gestoeld is op observationeel onderzoek, kunnen er een aantal terugkerende elementen en good practices worden opgelijst [expertgroep, 46]. De haalbaarheid van deze richtlijnen dient binnen elke pediatrie-setting te worden afgewogen ten aanzien van de bestaffing en de logistieke middelen die er zijn [46, 47].
Bij patiënten met anorexia nervosa kunnen volgende richtlijnen meegenomen worden:
Bovenstaande kan dus een doelstelling zijn, maar is vaak te moeilijk om onmiddellijk te verwachten.
Bij patiënten met ARFID is er uiteraard ook nood aan positieve ondersteuning, maar dit heeft een deels andere invulling dan bij AN, omdat de ondersteuning gericht is op angst om te proeven overwinnen en niet op angst voor gewichtstoename. Volgende elementen zijn belangrijk:
Voedingsadvies omvat onder meer een maaltijdplanning en psycho-educatie (over voeding, de algemene werkwijze, aanbevelingen …) en gebeurt in overleg met de patiënt (en zijn familie) [6, 44, 47, 51]. Aangezien personen met een eetstoornis vaak bepaalde gewoonten of rituelen hebben, is het daarnaast de taak van de hulpverlener om met zijn kennis van voeding het voedingspatroon uiteindelijk (stapsgewijs) te normaliseren [22]. De hulpverlener heeft hierbij de taak om ook de ouders van de patiënt in de behandeling te betrekken, zodat zij hun kind na ontslag voedingsmatig verder kunnen begeleiden [22].
De arts en/of diëtist formuleert, zo snel mogelijk na de aanmelding, een duidelijke voedingsdoelstelling met een bijhorend geïndividualiseerd maaltijdplan van 3 hoofdmaaltijden en 3 tussendoortjes om gewichtsherstel en normalisatie van het eetpatroon te bekomen [14, 41, 42, 45, 92]. Bij het opstellen van dit maaltijdplan is het van belang dat er ruimte is voor de autonomie van de patiënt, en er samenwerking met de patiënt kan zijn, doch binnen strikte grenzen. Op die manier is het zowel voor patiënt als alle teamleden duidelijk wat er verwacht wordt. Indien de patiënt er niet in slaagt de voedingsdoelstelling per maaltijd te behalen, wordt medische bijvoeding geïntegreerd in het eetschema en indien nodig sondevoeding ter aanvulling of als volledige voeding opgestart [22]. Op voorhand zijn hier duidelijke afspraken rond gemaakt en genoteerd in het zorgplan (zie hoofdstuk 3) [42, 45]. Dit dient dus op voorhand zeer duidelijk en voorspelbaar te zijn voor zowel de patiënt, de context en het team. Het eetschema wordt stapsgewijs uitgebreid en regelmatig geëvalueerd, waarbij sommige centra ‘standaardpakketten’ hanteren en andere ziekenhuizen individuele schema’s gebruiken op basis van de individuele (energie)behoeften en doelstellingen. Voor een adequaat individueel voedingsadvies is informatie nodig over de voedingstoestand, de voedingsbehoefte en de actuele voedingsinname.
Om de motivatie zich aan het voedseladvies te houden en mogelijkheid tot gevarieerd eten te versterken, kan de patiënt geïnformeerde keuzes (zie ook hoofdstuk 6) maken omtrent het hervoedingsproces (bv. welk type eten: medische bijvoeding, energierijke voeding of grotere porties) [22]. Sommige ziekenhuizen starten bijvoorbeeld ook met een eetschema op basis van wat de jongere al kent, zoals bepaalde gezinsgewoontes [46]. De hulpverlener kijkt wel streng genoeg toe of de patiënt met zijn keuzes voldoende kcalinname neemt om zijn gewichtsdoelstelling te bereiken [10, 22, 42, 92]. Discussies over niet-bediscussieerbare onderdelen van de behandeling van AN (bv. wekelijkse gewichtstoename, maaltijdmomenten, uiteindelijke voedseldoelstelling, …) worden vermeden. Bij medisch onstabiele patiënten of patiënten die angstig worden door de keuzes, worden de keuzemogelijkheden verkleind [22].
Hoewel oraal voedingsherstel steeds de voorkeur heeft, kan (gedwongen) sondevoeding (enterale voeding) bij gehospitaliseerde patiënten met een eetstoornis nodig zijn om ernstige complicaties af te wenden en overlijden te voorkomen [2, 9, 42, 48, 95]. Idealiter wordt sondevoeding zonder dwang en enkel als een laatste redmiddel geïntroduceerd, aangezien (gedwongen) sondevoeding forse consequenties kan hebben. Zo vergt het inbrengen van de neus-maagsonde een intensieve handeling die de integriteit van de patiënt aantast waarbij hij/zij alle autonomie verliest [95, 6, 58]. Voldoende emotionele ondersteuning bij het inbrengen van de sonde is dus absoluut vereist, alsook het geven van informatie en het kaderen van de sonde als een korte-termijn, tijdelijke, noodzakelijke interventie voor het lichaam-in-nood [2]. Parenterale voeding (via de bloedbaan) is echter niet aangewezen en mag men enkel toedienen bij patiënten zonder functioneel maagdarmstelsel [42].
Belangrijk, de patiënt moet altijd eerst voedsel voorgesteld zijn. Wanneer de patiënt niet in staat is om de voorgeschreven voedselinname te volgen na 24u, kan sondevoeding1 overwogen worden. Dit dient altijd in samenspraak te zijn met het kind/de jongere en hun ouders [2], alsook in proportie ten aanzien van het medisch risico. Daarnaast is het van belang om erop te waken dat dit proces (eerst voedsel voorstellen, weigering van voedsel,…) geen uitstel wordt van het krijgen van de benodigde calorieën voor de medische toestand waarvoor de patiënt opgenomen werd. De redenen voor opstart tot sondevoeding dienen dan ook op voorhand besproken te worden met de patiënt en de ouders. Hierbij moet aandacht zijn voor duidelijke informatie omtrent wanneer sondevoeding vereist is, zodat regie/autonomie van de patiënt toch zoveel mogelijk bewaard blijft [2, 46, 95]. Wanneer de beslissing voor dwangsondevoeding genomen is, dienen multidisciplinaire afspraken gemaakt te worden omtrent het moment, frequentie, locatie, en hoeveelheid van toediening van de sondevoeding, die helder en op een psychologisch veilige manier aan de patiënt worden toegelicht.
MEED stelt een aantal criteria voorop wanneer sondevoeding overwogen kan worden [2]:
Enterale sondevoeding (SV) kan (1) druppelsgewijs (continu of intermitterend) via een voedingspomp of (2) in bolus (per portie) via een voedingsspuit rechtstreeks in de sonde worden toegediend aan de patiënt. Er zijn voor- en nadelen verbonden aan elk van deze verschillende opties:
Het continu toedienen (ononderbroken 24u/24u druppelsgewijze SV via een voedingspomp; of 2x 10u met telkens 2u pauze zodat patiënt zich bv. makkelijk kan wassen) van de sondevoeding heeft als voordeel dat de patiënt zich zowel psychologisch als fysiologisch (metabool) voorzichtig kan aanpassen aan de toenemende voedselinname [22, 48], gezien de erg geleidelijke toediening van de voeding. Het nadeel van deze optie is dat de patiënt geen “eetvrije” tijd heeft doorheen de dag, wat mentaal belastend kan zijn. Ook de stap naar de herstart of opdrijven van eigen orale intake kan als moeilijker worden beschouwd, omdat men de perceptie heeft dat alle nodige voeding toch reeds via de sonde wordt toegediend. Op die manier bestaat het risico dat er een passieve situatie van gevoed worden ontstaat, waarbij de eetstoornis de controle over de patiënt behoudt (AN), hoewel dit voor ARFID wel helpend kan zijn.
Bij intermitterende druppelsgewijze SV wordt de nodige hoeveelheid SV verdeeld over een aantal vastgelegde tijdstippen (doorgaans 4). Afdelingen verschillen in de manier waarop ze deze aanpak uitvoeren. Sommige pediatriediensten geven patiënten bij elk voedingsmoment de kans om eerst voldoende inname te bereiken met gewone voeding per maaltijd. Hierin krijgt de patiënt de info dat de calorische waarde van de eigen intake in mindering wordt gebracht bij de daaropvolgende hoeveelheid SV die zal worden toegediend. Het nadeel van deze methodiek is dat ze vrij tijdsintensief is voor zorgverstrekkers en veel motivationeel werken vereist. Deze methodiek kan echter op korte tijd het herstel van het eetgedrag bevorderen, omdat de SV als alternatief voor de eigen intake wordt vooropgesteld, en niet als voeding die erbij komt, bovenop de eigen intake. Andere diensten laten het toedienen van extra sondevoeding niet afhangen van wat er gegeten wordt op het moment zelf; er wordt per 2 à 3 dagen opnieuw geëvalueerd. Dit geeft als voordeel dat er minder conflict en onderhandeling optreedt tussen de patiënt en de verpleegkundige. Wat de strategie rond bijvoeding en sondevoeding ook is, het is wezenlijk dat er een gedeelde visie is binnen het team, zodat de moeilijke stap om tot sondevoeding over te gaan, zo sereen mogelijk kan verlopen voor patiënt, gezin en zorgteam.
Bij de keuze voor deze intermitterende vorm van druppelsgewijze SV zijn een aantal zaken van groot belang:
Intermitterende SV kan ook louter tijdens de nacht worden toegediend. Dit heeft als voordeel dat het eetschema overdag zo min mogelijk verstoord geraakt. De patiënt krijgt hierbij overdag bij elk eetmoment de kans om de vooropgestelde maaltijden te eten en in een tweede stap de niet genuttigde maaltijden bij te passen met bijvoeding. Indien ook bijvoeding niet haalbaar is, wordt de nodige hoeveelheid SV voor ’s nachts berekend en wordt de SV sondevoeding aangekoppeld na het laatste eetmoment ’s avonds tot vroeg in de ochtend. Het nadeel van deze optie is dat het ’s nachts voeden ingaat tegen de natuurlijke fysiologische processen van rust die het menselijk lichaam normaliter doorloopt tijdens de slaap. Daarnaast blijken sommige tieners ’s nachts meer slaapproblemen te ervaren, en is de kans groter dat de sonde ’s nachts (gezien er dan minder toezicht is) gemanipuleerd wordt, wat bijzonder gevaarlijk kan zijn.
Het aanbieden van sondevoeding in bolus heeft als voordeel dat de sondevoeding nog beter kan worden afgestemd op de eigen intake van de patiënt, en de normale maaltijdcyclus optimaal kan worden nagebootst. Bijkomend is de tijdsduur van toediening van de SV veel korter, en heeft de patiënt dus veel meer “eetvrije” tijd. Sondevoeding wordt in dit geval toegediend vlak na de maaltijdmomenten, wanneer deze niet volledig werd genuttigd, en dit via een voedingsspuit rechtstreeks in de sonde. De calorische waarde van de sondevoeding is hierbij het equivalent van de calorische waarde van de maaltijd die op dat moment werd voorzien. Hierbij krijgt men eerst de reguliere maaltijd aangeboden, en krijgt men in een tweede stap de kans om het niet-genuttigde deel bij te passen met vloeibare bijvoeding die in een glas wordt gegoten. Wanneer de patiënt er niet in slaagt om de bijvoeding op te drinken wordt de bijvoeding (of het equivalent in SV) met een voedingsspuit opgetrokken en (zichtbaar voor de patiënt) in de sonde gespoten. Tijdens deze verpleegkundige act is het van belang om veilig en geruststellend te blijven communiceren met de patiënt. Het overdag aanbieden van sondevoeding in bolus sluit het best aan bij het normale fysiologische eetgedrag van mensen, maar heeft als nadeel dat de relatief grote portie voeding die op korte tijd in de maag terecht komt een gevoel van misselijkheid kan geven. Ook psychologisch melden patiënten een grote psychologische belasting na toediening van SV via bolus, waarbij enerzijds het zware gevoel op de maag (fysieke gewaarwording) en anderzijds het zien van de ‘grote’ hoeveelheid voeding die in één keer wordt toegediend, tot emotionele spanning leidt.
Bovenstaand overzicht toont aan dat er aan elke optie voor- en nadelen zijn verbonden. Het is aan het team om de best passende optie te bepalen in functie van de noden van de patiënt, de visie van het team en de logistieke middelen die het ziekenhuis heeft
Er bestaat gen eenduidige richtlijn met betrekking tot het al of niet tussentijds verwijderen of laten zitten van de sonde. Hierin kunnen afdelingen verschillen qua beleid. Zo gaan sommige afdelingen de sonde systematisch verwijderen na het eetmoment, terwijl anderen ervoor kiezen om de sonde eenmalig aan te brengen en gedurende de volledige periode waarin sondevoeding toegediend wordt, te laten zitten. Afdelingen die ervoor kiezen om de sonde te laten zitten, doen dit vaak vanuit volgende argumenten: Het plaatsen van de sonde is vaak een moeilijke opdracht bij patiënten met een eetstoornis, daarom kan men er dus voor kiezen om de sonde na plaatsing (en controle van de ligging van de sonde) te laten zitten. Daarnaast lijken patiënten met ernstige ondervoeding vaak hypersensitief voor pijn en vormt het herhaaldelijk plaatsen/verwijderen van de sonde psychologisch een extra belasting. Indien men opteert voor het laten zitten van de sonde, wordt er bij voorkeur gekozen voor een polyurethaan (PUR) sonde. Deze sonde is niet alleen comfortabel en soepel (en veroorzaakt dus minimale hinder voor de patiënt), maar hoeft ook minder vaak verwisseld te worden dan een siliconen-sonde. Een PUR sonde kan 6-8 weken blijven zitten. Dagelijkse controle van de ligging van de sonde via een pH-meting blijft aangewezen. Het telkens verwijderen van de sonde berust ook op een aantal belangrijke argumenten. Zo kan bij elke maaltijd opnieuw de kans op orale voeding vergroot worden (elke maaltijd is dan een nieuwe kans voor de patiënt om voldoende voedselinname zonder sondevoeding te bereiken). De opstart van sondevoeding houdt namelijk een risico in dat de patiënt met AN niet meer in staat is terug over te stappen naar orale voedselinname [2]. Anderzijds kan het verwijderen van de sonde ook belangrijk zijn omwille van veiligheidsredenen (manipulatie van de sonde, suïcide risico). Het verwijderen van de sonde na het voedingsmoment kan ook irritatie op de huid, in de keel, neus of slokdarm vermijden. Echter, bij ARFID is het systematisch verwijderen (en terug inbrengen) van de sonde na elk eetmoment tegenaangewezen, gezien dit extra druk creëert en gezien de sensorische gevoeligheid (ook in het mondgebied) die vaak aanwezig is bij deze patiënten.
Toch zijn er een aantal belangrijke aandachtspunten. Hier is het opnieuw van belang dat er een gedeelde visie is bij het team omtrent het telkens verwijderen van de sonde of het langdurig laten zitten van de sonde. Eender of men er voor kiest om de sonde bij elk voedingsmoment te plaatsen en nadien te verwijderen, dan wel om de sonde langdurig te plaatsen en te laten zitten tot er geen SV meer vereist is, is het belangrijk dat het inbrengen van de sonde niet als strafmaatregel gebruikt wordt [95]. Het creëren van een veilige en verzorgende/begripvolle setting voor het ongemak dat gepaard gaat met de plaatsing van een sonde vormt dus een belangrijk uitgangspunt. Leg hierbij duidelijk uit wat er gaat gebeuren, wanneer, waarom, waar en hoe de plaatsing van de sonde zal plaatsvinden, aangepast aan het ontwikkelingsniveau van de patiënt. Bied hoop en perspectief, en benoem duidelijk dat het een tijdelijke interventie is, die omwille van het lichaam-in-nood absoluut noodzakelijk is, zodat het lichaam de voedingsstoffen krijgt die het nodig heeft. Eenmaal de sonde is aangebracht, is het belangrijk om dit goed te monitoren. Wanneer sondevoeding onvoldoende gemonitord wordt bij patiënten met een eetstoornis, bestaat het gevaar dat de kinderen/jongeren hun sonde proberen te verwijderen, wat gepaard kan gaan met snijwonden maar ook gevaren inhoudt doordat de sonde gemanipuleerd wordt, alsook dat ze de sondevoeding laten verdwijnen in het toilet,… [2].
Meer info omtrent de werkwijze en tips kan je vinden in het document K-EET dwangsondevoeding [95].
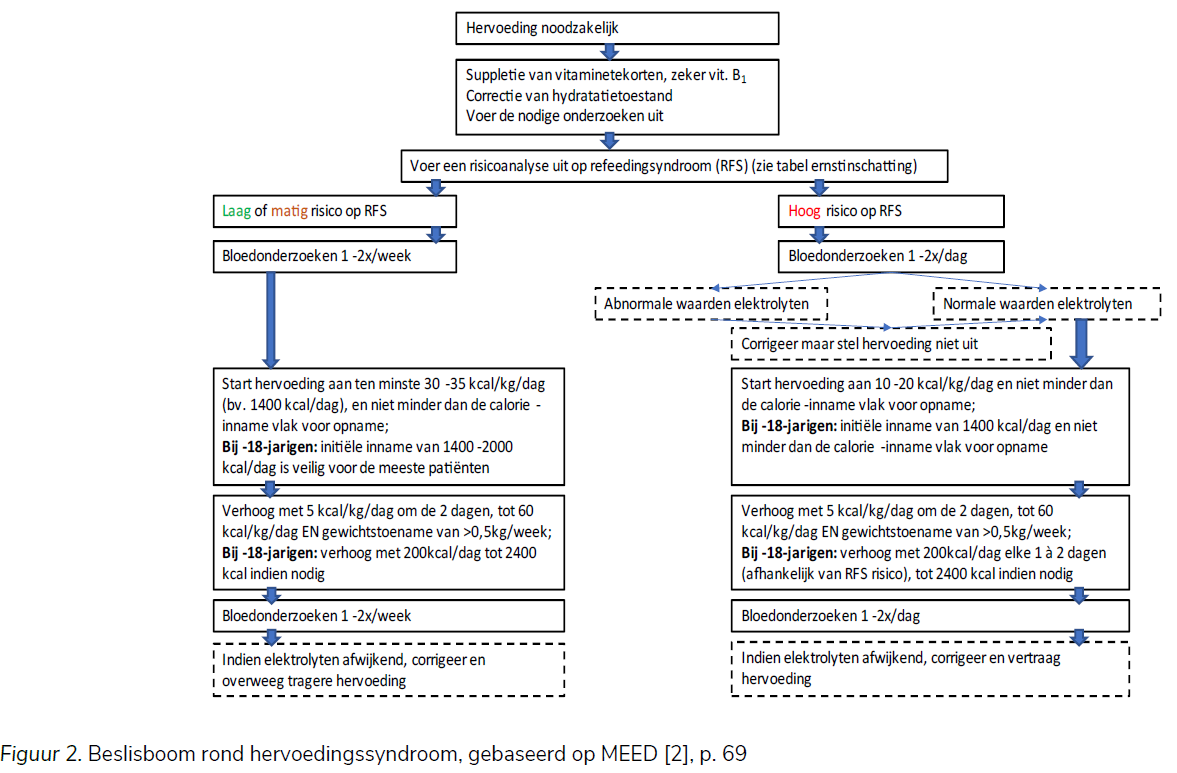
Hoewel de literatuur algemeen gezien op het belang van voedingsherstel bij medisch-pediatrische stabilisatie wijst, verschillen de richtlijnen (en centra) in de starthoeveelheid calorie-inname en de mate van energieverhoging onderling vaak substantieel [9, 96, 97]. Het voedingsadvies wordt aldus best opgesteld op basis van een overleg tussen de verantwoordelijke kinderarts en de diëtist, waarbij de huidige fysiologische parameters, en de gegevens uit het diëtistisch onderzoek de basis vormen voor het bepalen van het voedingsschema. Het is dan ook belangrijk om een risico-analyse uit te voeren op het refeeding syndroom [2]. Dit is belangrijk aangezien het noodzakelijk is om een balans te vinden tussen voldoende snel in gewicht toenemen enerzijds, en anderzijds het refeeding syndroom voorkomen (zie hoofdstuk 5), gezien het te snel hervoeden ook tot medische complicaties kan leiden en soms zelfs fataal is [2, 9]. Binnen de MEED-richtlijn wordt ook een beslissingsboom meegegeven die gebruikt kan worden als mogelijk handvat [2]. Deze flowchart is ook weergegeven hieronder in Figuur 2. In tegenstelling tot de klassieke opinie om gewichtstoename geleidelijk te laten verlopen, zowel om ‘refeeding syndroom’ te vermijden als om de weerstand en angst voor het bijkomen bij de patiënt hanteerbaar te houden, bevelen meer en meer huidige richtlijnen (consensus en literatuur/onderzoek) voor residentiële behandelingen echter een vrij hoge energieherwinning aan, bij gemiddeld ondervoede patiënten, waarbij een arts de risicofactoren voor het refeeding syndroom monitort [9, 17, 41, 48, 52, 91, 98]. Zo worden elektrolyten en medische complicaties gemonitord en indien nodig fosfaat toegediend. Met een snelle hervoeding blijkt de ziekenhuisopname immers korter en verhoogt het de mate van gewichtstoename zonder dat het aantal gevallen van refeeding syndroom toeneemt [41, 52].
Samengevat, bij patiënten met milde tot matige ondervoeding, is het niet noodzakelijk om te starten met een lage hoeveelheid calorieën en deze langzaamaan op te bouwen, op voorwaarde dat patiënten medisch worden opgevolgd, bij voorkeur totdat de bloedwaarden genormaliseerd zijn [41, 15]. Bij patiënten met ernstige ondervoeding (zie hoofdstuk 3) is het evenwel aanbevolen om voorzichtig te starten met het opbouwen van voeding [98, 9, 17]. Hiernavolgend worden enkele algemene richtlijnen gegeven m.b.t. de bepaling van de passende start- en toenamewaarde. We geven ook de flowchart mee uit de MEED-richtlijn als mogelijk handvat [2].
De energie-inname waarmee gestart wordt, mag alvast niet lager zijn dan de energie-inname voorafgaand aan de opname om verdere ondervoeding te voorkomen [2, 41, 45]. Verschillende ziekenhuizen en richtlijnen starten met 1200 tot 1400 kcal of meer per dag bij ernstig ondervoede patiënten. Dit is lager dan bij matig ondervoede patiënten, waarbij de MEED-richtlijn verwijst naar 1400 à 2000kcal/dag [2], terwijl een andere studie een veilige behandeling aantoont met een initiële calorie-inname van 2200 tot 2600 kcal per dag [9]. Echter, gezien er een correlatie tussen ernstig ondervoede kinderen (<70% median BMI) en het refeeding syndroom is, dienen pediaters bij hen voorzichtiger te hervoeden tot er meer studies zijn [9]. Zo hanteren bepaalde gespecialiseerde eetstoornisklinieken volgende richtlijnen: initieel niet minder eten dan thuis; wanneer er voorafgaand aan de opname een voedingsstop is bij de patiënt en er een groot risico is op refeeding syndroom (vb. BMI < 12), dan wordt gestart met een calorie-inname van 500Kcal / dag met een dagelijkse monitoring en opbouw.
De MEED-richtlijn schrijft voor dat constante monitoring nodig is, zonder dat een ‘overbezorgde aanpak’ nodig is [2]. Vanuit good practice verwachten we eerder een gewichtstoename van 0.5 – 1 kg per week (waarbij 0.5 kg meer realistisch is wanneer er geen sondevoeding wordt toegediend, en enkel louter wordt gewerkt op herstel van eigen intake bij patiënten die dit mentaal aankunnen). Vanuit de MEED-richtlijn kan gesteld worden dat het veilig is, voor de meeste patiënten om het hervoeden te starten met een calorie-inname van 1400-2000kcal/dag, en waarbij 200kcal per dag extra toegevoegd worden. Bij patiënten met een hoger risico op refeeding syndroom moet een individuele inschatting gemaakt worden [2]. Op basis van een andere studie wordt gesteld dat bij een ernstige ondervoeding de startwaarde dus lager zal liggen, van 20 kcal per kg lichaamsgewicht per dag tot zelfs 5 à 10 kcal/kg/dag [88].
Om verdere ondervoeding te voorkomen blijft het belangrijk om voldoende calorietoename te voorzien doorheen het behandelproces. Vanuit een klinisch standpunt worden patiënten met anorexia nervosa immers vaak gekenmerkt door hypermetabolisme (toename in rustmetabolisme) in de periode van gewichtsherstel. Dit betekent dat ze een hogere calorie-inname nodig hebben voor gewichtsstijging/-stabilisatie dan een persoon met een normaal metabolisme [52]. De energie-aanbreng die nodig is voor het herstel van een gezond lichaamsgewicht is individueel bepaald per patiënt, waarbij de klinische ervaring van de diëtist en arts hier doorslaggevend lijkt, aangezien beschikbare formules onbetrouwbaar blijken [94, 99, 100]. Continue opvolging van de energie-inname (bv. onder de vorm van registratie in het EPD) is sterk aanbevolen [41, 77, 101].
Toch zijn er een aantal handvatten voor veilig hervoeden. Recente studies bij volwassenen tonen hierbij een veilige hervoeding bij een startwaarde tussen de 1600 en 2400 kcal met een toename van 200 tot 500 kcal elke 1 tot 3 dagen, weliswaar met een nauwkeurige opvolging om het refeeding syndroom op te sporen en te voorkomen [91]. Ook een toename van 300 tot 400 calorieën elke 3 a 4 dagen lijkt veilig te zijn voor het refeeding syndroom om toch voldoende gewicht bij te komen. Bij adolescenten wordt een startwaarde tussen 1400 en 2000kcal/dag2 naar voren geschoven, met een toename van 200 kcal elke dag [2]. Patiënten met een ernstige ondervoeding zullen op termijn een hogere kcal inname (3500-4000 kcal/dag) nodig hebben om consistent in gewicht te blijven toenemen nadat ze medisch gestabiliseerd zijn (tijdens de beginfase van hervoeding). Deze verhoogde inname kan in sommige gevallen al op de afdeling gestart worden, en verdergezet worden in ambulante opvolging (na ontslag bij medische stabilisatie) tot het ideaal gewichtsherstel bereikt is3. Bij het bereiken van het herstelgewicht dient een herevaluatie van de voedingsnoden te gebeuren om het behoud van gewicht of groei verder te ondersteunen [91].
Hervoeden van cliënten brengt echter ook heel wat psychologische effecten met zich mee. Het bijkomen in gewicht is absoluut noodzakelijk voor het lichamelijk herstel, maar zorgt er tegelijkertijd ook voor dat de eetstoornisstem bij AN (afhankelijk van de motivationele fase waarin de patiënt zich bevindt) sterker wordt, en de patiënt zich net emotioneel neerslachtiger gaat voelen. Bijkomend zal anorexia de patiënt er proberen toe te brengen om op andere manieren te compenseren voor de extra calorie-inname. Vaak wordt een toename van beweegdrang geobserveerd bij deze patiënten, wat een belangrijk aandachtspunt vormt oor de psycholoog. Ook is het belangrijk om andere afspraken te maken, bv. loszittende kledij voorzien zodat de patiënt geen biofeedback krijgt van kledij die begint te spannen.
De MEED richtlijn stelt volgende flowchart voor in functie van het risico op hervoedingssyndroom, met afzonderlijke waarden voor minderjarigen.
Referenties